流感高发季再现“三高”格局,后疫情时代如何构建更智慧的防线?|健康素养66条
来源:CHTV百姓健康2025-12-27 18:22:14
医生,我明明做好了防护,为什么还会感染?
家里人都没事,怎么就孩子高烧不退?
我都打过三针疫苗了,怎么症状比没打的同事还重?
这些在发热门诊随处可见的问题,不再能用教科书上的经典理论轻松回答。
国家疾控局2025年11月的疫情数据显示,全国一个月内报告的法定传染病接近540万例[1]。此外,以流感为代表的呼吸道传染病正处高发季,单月报告病例数超过157万[2],而病毒性肝炎、新型冠状病毒感染、肺结核等“老牌”传染病,则持续占据乙类传染病报告数的前列[1]。
当下传染病防控一方面,新发突发呼吸道传染病威胁不断;另一方面,经典传染病依然构成沉重的疾病负担,反映出病原体与人类社会的持续博弈。而博弈的胜负,取决于传染病流行的三个基本环节——传染源、传播途径、易感人群。《中国公民健康素养——基本知识与技能(2024年版)》第29条强调:传染源、传播途径和易感人群是传染病流行的三个环节,防控传染病人人有责。概念虽是老生常谈,但过去的几年,全球科学界以前所未有的速度和规模,推动着对这些经典概念的认知革新。

传染源:从确诊病例向排毒动态前移
在传统防控模型里,传染源通常指出现典型症状、能被明确诊断的病例,管理策略的核心是诊断-隔离。然而,无论是当前高发的流感,还是持续存在的新冠病毒感染,大量研究证据正在推动这一认知前移:管理的核心目标转向“具有传染性的排毒者”[3]。
对于流感病毒,研究已证实感染者在出现明显发热、咳嗽前,病毒排出量可能已接近峰值。这意味着,当个体因感觉不适而前往医院时,其造成传播的高风险窗口可能已接近尾声。中国疾控中心发布的监测报告显示,在门急诊流感样病例中,流感病毒检测阳性率居首位,提示大量传染源在出现症状初期就已活跃于社区。这使得完全依赖被动门诊监测的系统,存在天然的时间延迟。
“无症状感染者”因没有临床症状,完全隐匿于常规监测网络之外,却可能持续排出病原体。这为“扩大检测”“对重点人群筛查”等公共卫生措施提供了核心科学依据——目的不仅是诊断疾病,更是为了在更早的时间点,绘制出社区中潜在的“排毒者地图”,从而实现精准拦截。
此外,对传染源的理解早已超越“人”的范畴。环境储源(如诺如病毒污染物体表面)和动物宿主(如众多人畜共患病的自然宿主)是更深层、更持久的威胁。最新科学研究通过病原体基因组监测,不断在野生动物群体中发现庞大的病毒多样性库,揭示了传染病从动物“蓄水池”向人类溢出的长期风险。这要求我们的防控视野,必须从医院和社区,拓展至更广阔的“同一健康”(One Health)生态领域。
有效的源头控制,必须是一个整合了临床病例报告、主动病原筛查、环境监测及动物疫病监测的立体防御体系。其目标是管理整个排毒期,而不仅仅是发病期。
而面对无症状传播和气溶胶传播的挑战,传统的检测方法已经显得力不从心。近年来,随着技术的进步,新的检测手段不断涌现。我国科学研究团队研发CRISPR-Cas13快速检测技术,采用RT-RPA等温扩增结合Cas13a旁切活性,可在30分钟内筛查环境样本中的病原体,无需复杂设备,可在现场部署[4],这一进展让传染病监测从实验室走向现场成为可能。

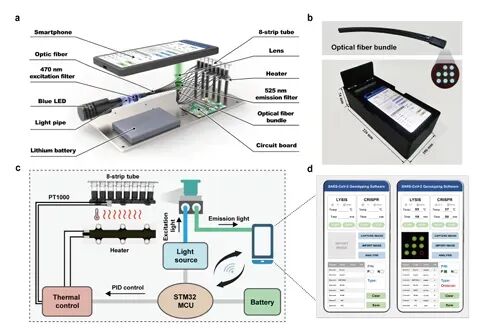
实验中基于手机的光纤集成设备
图源:Biosens Bioelectron. 2023 Jun 1;229:115238.
当病毒“搭乘”现代化快车,精准防控要升级
传统上传播途径划分为飞沫、接触、空气、粪口等类别,然而,前沿研究不断揭示,病原体的传播是一个受多种物理和环境因素影响的复杂连续谱,阻断传播也因此从针对单一途径的分类阻断,进化到改造传播环境的立体干预。
过去几年,世界卫生组织(WHO)和美国疾控中心(CDC)先后基于新的科学证据,更新指南,明确承认SARS-CoV-2可通过气溶胶传播,尤其是在密闭、拥挤、通风不良的室内环境。一篇发表在《科学》上的重要综述指出,感染者呼吸、说话时产生的、粒径不一的呼吸颗粒中,微小的气溶胶(通常指粒径<5微米)可以在空气中悬浮数分钟至数小时,并随气流扩散到整个房间,是导致“超级传播事件”和远距离(通常指超过1-2米)传播的关键因素[5]。中国疾控中心发布的关于奥密克戎变异株传播特征的文件也明确指出,在不通风的密闭环境中,气溶胶传播的风险显著增加[6]。
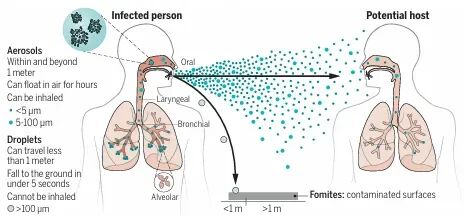
图源: Science. 2021 Aug 27;373(6558):eabd9149.
与此同时,我们对接触传播的理解也趋于精细化。虽然物体表面(污染物)传播被证实是诺如病毒、耐甲氧西林金黄色葡萄球菌(MRSA)等病原体的主要途径,但对于新冠病毒,美国疾控中心的科学简报指出,通过接触被污染的物体表面感染的风险被认为较低[7]。这有助于将公众的注意力与公共卫生资源,更精准地投向风险更高的气溶胶传播阻断。
因此,当代的传播途径阻断,是一张由 “个人科学防护(口罩)”、“环境工程干预(通风)”、“精准消毒策略”和“主动传播监测(废水)” 共同编织的立体防线:
个人防护的升级仅保持社交距离可能不足。在室内公共场所、尤其是高风险环境(如医疗机构、公共交通),佩戴能高效过滤气溶胶的口罩(如N95/KN95),其保护意义远大于仅防飞沫的普通外科口罩。
环境干预的兴起阻断传播不再仅仅依赖个人行为,更依赖于工程控制。加强通风、引入HEPA过滤等空气净化设备、控制室内人员密度,成为与隔离传染源同等重要的基础措施。这标志着防控思维从管理个体到管理环境空气的范式转变。
超越群体免疫,脆弱的“我们”并不相同
阻断病毒传播的立体防线后,那么防线保护的核心对象是谁?所有人的风险是否均等?疫情的历程告诉我们答案是否定的。面对一种新型病原体,人群在初期往往普遍易感。但随着病情发展,感染后的结局——是无症状、轻症还是重症危重症——在人群中的分布绝非随机。
生物学差异是构成风险分层的基石。大量数据表明,老年人群是流感、新冠肺炎等呼吸道传染病重症和死亡的最高风险群体。随年龄增长,免疫系统功能下降,对新型病原体的应答能力减弱,且常伴有多种基础疾病。
国际上的大规模全基因组关联研究(GWAS)已识别出多个与新冠肺炎重症风险相关的基因位点,例如与I型干扰素免疫应答通路相关的基因[8]。这从遗传学角度解释了,为何在相似暴露条件下,不同个体的疾病严重程度存在巨大差异。
在可干预的医学手段中,疫苗接种是改变人群易感性格局最有力的工具。它将个体从易感者转变为免疫者,直接降低感染和重症风险。然而,疫苗的保护并非静态,病毒变异可能导致免疫逃逸,抗体水平随时间会自然衰减。因此,根据流行毒株及时更新疫苗成分、对重点人群进行定期加强免疫,是维持保护效力的关键。面对“疫苗犹豫”这一社会心理挑战,医护人员基于证据的清晰沟通和引导,是构建社会免疫屏障不可或缺的一环。
最终,个体健康素养与行为选择,是否在流行季科学佩戴口罩、是否在不适时主动居家休息、是否及时接种最新疫苗,这些行为直接决定了个人暴露于风险的概率和频率。

结语
参考文献
[1] 国家疾病预防控制局.2025年11月全国法定传染病疫情概况.https://www.cdctj.com.cn/system/2025/12/08/030180428.shtml
[2]https://www.chinacdc.cn/jksj/jksj01/202510/t20251011_312919.html
[3] He X, Lau EHY, Wu P, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19[J]. Nat Med. 2020 May;26(5):672-675. Doi: 10.1038/s41591-020-0869-5.
[4] Wang Y, Chen H, Gao H,et al. CESSAT: A chemical additive-enhanced single-step accurate CRISPR/Cas13 testing system for field-deployable ultrasensitive detection and genotyping of SARS-CoV-2 variants of concern. Biosens Bioelectron. 2023 Jun 1;229:115238. Doi: 10.1016/j.bios.2023.115238. Epub 2023 Mar 20.
[5] Wang CC, Prather KA, Sznitman J,et al. Airborne transmission of respiratory viruses[J]. Science. 2021 Aug 27;373(6558):eabd9149. Doi: 10.1126/science.abd9149.
[6] 中国疾病预防控制中心. 奥密克戎变异株防控问答(更新版)[EB/OL]. (2023-01-05)[2024-01-15]. http://www.chinacdc.cn/jkzt/crb/zl/szkb_11803/jszl_13141/202301/t20230105_263299.html.
[7] Centers for Disease Control and Prevention. Science Brief: SARS-CoV-2 Transmission[EB/OL]. (2021-04-05). https://www.cdc.gov/coronavirus/2019-ncov/science/science-briefs/sars-cov-2-transmission.html.
[8]COVID-19 Host Genetics Initiative. Mapping the human genetic architecture of COVID-19[J]. Nature. 2021 Dec;600(7889):472-477. Doi: 10.1038/s41586-021-03767-x.


 CHTV 百姓健康微信
CHTV 百姓健康微信